题型:综合题 题类:常考题 难易度:普通
2016-2017学年山东省烟台市高一下学期期中化学试卷
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
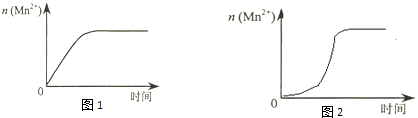
①该小组同学提出的假设是.
②请你帮助该小组同学完成实验方案,并填写表中空白.
实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
③若该小组同学提出的假设成立,应观察到的现象是.
编号 | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶解 的时间/s |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | t1 |
E | 2 | 细小颗粒 | 15 | t2 |
F | 2 | 粉末 | 15 | t3 |
G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
实验序号 | 金属 质量/g | 金属状态 | C(H2SO4) /mol•L﹣1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
反应前 | 反应后 | ||||||
1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 数据模糊A |
4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 35 | 数据模糊B |
6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 数据模糊C |
7 | 0.10 | 丝 | 1.0 | 50 | 数据模糊D | 50 | 50 |
8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
9 | 0.10 | 丝 | 1.1 | 50 | 30 | 未测数据 | 40 |
分析上述数据,回答下列问题:
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化).限选试剂和仪器:0.20mol/LH2C2O4溶液、0.010mol/LKMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量 | V(0.20mol/H2 | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 50 | |
② | 2.0 | 0 | 4.0 | 25 | |
③ | 1.0 | a | 4.0 | 25 |
| 实验操作及现象 | 实验结论 | |
| A | 向2mL5%的双氧水中分别滴加2滴0.1mol/L的Fe2(SO4)3和0.1mol/L的CuSO4溶液,前者产生气泡较快 | 对双氧水分解催化效率:Fe3+>Cu2+ |
| B | 向2mL0.1mol/L酸性KMnO4溶液中分别滴加3mL0.1mol/L和3mL0.2mol/L的H2C2O4溶液,后者首先褪色(提示:反应的部分关系为2MnO4-+5H2C2O4—2Mn2++10CO2) | 其他条件不变时,H2C2O4的浓度越大,化学反应速率越快 |
| C | 取两支试管a和b,各加入5mL0.1mol/LNa2S2O3溶液;另取两支试管c和d,各加入5mL0.1mol/LH2SO4溶液;将a、d放入热水浴中, B、c放入冷水浴中,一段时间后分别混合,热水浴中先出现浑浊。(S2O32-+2H+=SO2↑+S↓+H2O) | 温度越高,反应速率越快 |
| D | 用3mL稀H2SO4溶液与足量Zn反应,当气泡稀少时,加入1mL浓H2SO4 , 又迅速产生较多气泡 | H2SO4浓度增大,反应速率加快 |
试题篮