题型:实验探究题 题类:模拟题 难易度:普通
Ⅰ.称取7.0g工业废铁粉放入烧杯中,先用热的Na2CO3溶液洗涤,再水洗,最后干燥。
Ⅱ.称取6.0g上述处理后的铁粉加入25mL某浓度硫酸中加热,加热过程中不断补充蒸馏水,至反应充分。
Ⅲ.冷却、过滤并洗涤过量的铁粉,干燥后称量铁粉的质量。
Ⅳ.向步骤Ⅲ的滤液中加入适量(NH4)2SO4晶体,搅拌至晶体完全溶解,经一系列操作得干燥纯净的(NH4)2Fe(SO4)2•6H2O。
V.将(NH4)2Fe(SO4)2•6H2O脱水得(NH4)2Fe(SO4)2 , 并进行热分解实验。
已知在不同温度下FeSO4•7H2O的溶解度如表:
|
温度(℃) |
1 |
10 |
30 |
50 |
|
溶解度(g) |
14.0 |
17.0 |
25.0 |
33.0 |
回答下列问题:


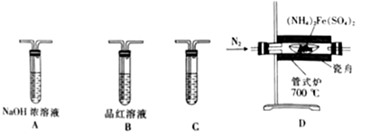
①检验气态产物中的SO2和SO3时,装置连接顺序依次为1(气流从左至右);C中盛放的试剂为2。
②装置A的作用是3。
③检验充分分解并冷却后的瓷舟中铁的氧化物中是否含有二价铁,需用到的试剂为4。




| 选项 | 实验目的 | X中试剂 | Y中试剂 |
| A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
| B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
| C | 用Na2SO3和浓硫酸制取收集SO2并检验其性质 | 品红溶液 | 浓硫酸 |
| D | 用CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和Na2CO3溶液 | 浓硫酸 |
试题篮