修改时间:2024-11-06 浏览次数:280 类型:高考模拟
| 选项 | 实验 | 现象 | 结论 |
| A | 将镁条点燃后迅速伸入充满N2的集气瓶中 | 集气瓶内有黄绿色粉末产生 | N2具有氧化性 |
| B | 向2mLNa2S稀溶液中滴加0.1mol/LZnSO4溶液至不再有白色沉淀产生,然后再往上述溶液中滴加0.1mol/LCuSO4溶液 | 沉淀由白色变为黑色 | Ksp(ZnS)>Ksp(CuS) |
| C | 将镁片和铝片分别打磨后,用导线连接再插入NaOH溶液中 | 片刻后镁片上有大量气泡产生,铝片上产生的气泡很少 | 镁为电池正极 |
| D | 将装有CuCl2∙2H2O晶体的试管加热,在试管口放置湿润的蓝色石蕊试纸 | 试纸变为红色 | CuCl2显酸性 |

已知几种氢氧化物的Ksp 的值如下表:
| 氢氧化物 | | | | |
| Ksp | | | | |
请回答下列问题:
| 实验次数 | 1 | 2 | 3 |
| Na2S2O3标准液体积/ | 23.20 | 24.80 | 25.20 |
已知:I2+2Na2S2O3=2NaI+Na2S4O6
①滴定达到终点时溶液的颜色变化为。
②富锰渣中铁的含量为。
②
③
则 的
(用含
、
、
的代数式表示)。
①下列说法正确的是(填字母)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加 的量,平衡正向移动
②达到平衡时 的浓度为1.4 mol·L−1 , 充入一定量的
,反应再次达到平衡,
浓度(填“
”“
”或“
”) 1.4 mol·L−1。

① (填“
”“
”或“
”)0;比较
、
、
的大小:。
②若初始时通入 ,
为
,则
点平衡常数
(用气体平衡分压代替气体平衡浓度计算,分压
总压
气体的物质的量分数,写出计算式即可)。
①ClO4-的空间构型为。
②CTCN的化学式为 ,与Co3+形成配位键的原子是。(已知CO32−的结构式为
![]() )
)
③ 可以
![]() (双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为,
(双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为,
![]() 中含有σ键的物质的量为。
中含有σ键的物质的量为。
④ 是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为。


Ⅰ.称取7.0g工业废铁粉放入烧杯中,先用热的Na2CO3溶液洗涤,再水洗,最后干燥。
Ⅱ.称取6.0g上述处理后的铁粉加入25mL某浓度硫酸中加热,加热过程中不断补充蒸馏水,至反应充分。
Ⅲ.冷却、过滤并洗涤过量的铁粉,干燥后称量铁粉的质量。
Ⅳ.向步骤Ⅲ的滤液中加入适量(NH4)2SO4晶体,搅拌至晶体完全溶解,经一系列操作得干燥纯净的(NH4)2Fe(SO4)2•6H2O。
V.将(NH4)2Fe(SO4)2•6H2O脱水得(NH4)2Fe(SO4)2 , 并进行热分解实验。
已知在不同温度下FeSO4•7H2O的溶解度如表:
|
温度(℃) |
1 |
10 |
30 |
50 |
|
溶解度(g) |
14.0 |
17.0 |
25.0 |
33.0 |
回答下列问题:
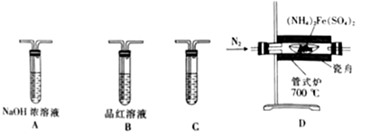
①检验气态产物中的SO2和SO3时,装置连接顺序依次为(气流从左至右);C中盛放的试剂为。
②装置A的作用是。
③检验充分分解并冷却后的瓷舟中铁的氧化物中是否含有二价铁,需用到的试剂为。


已知: ![]() +
+ 
 +H2O
+H2O
试题篮