题型:单选题 题类:常考题 难易度:容易
I.取5mL 0.1mol/L的KI溶液,滴加5﹣6滴FeCl3稀溶液;
Ⅱ.继续加入2mLCCl4振荡
Ⅲ.取萃取后的上层清液,滴加KSCN溶液.
(1)探究活动I的实验现象为{#blank#}1{#/blank#} .
探究活动Ⅱ的实验现象为{#blank#}2{#/blank#}
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色.对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察.
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4﹣反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高.
结合新信息,现设计以下实验方案验证猜想:
①请完成下表
实验操作 | 现象和结论 |
步骤一:{#blank#}3{#/blank#} | 若产生蓝色沉淀,则{#blank#}4{#/blank#} . |
步骤二:{#blank#}5{#/blank#} | 若乙醚层呈血红色,则{#blank#}6{#/blank#} . |
②写出实验操作“步骤一”中的反应离子方程式:{#blank#}7{#/blank#} .
Ⅳ.为了测定探究活动I中的FeCl3稀溶液的浓度,现进行以下操作:
①移取25.00mLFeCl3稀溶液至锥形瓶中,加入{#blank#}8{#/blank#} 用作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点时的现象是{#blank#}9{#/blank#} .
②重复滴定三次,平均耗用c mol/LKI标准溶液VmL,则FeCl3稀溶液物质的量浓度为{#blank#}10{#/blank#} mol/L.
③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果{#blank#}11{#/blank#} (填“偏高”或“偏低”或“不变”).
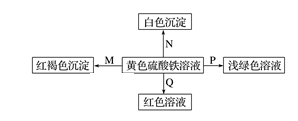
| 选项 | M | N | P | Q |
| A | NH3·H2O | Ba(OH)2 | 铜 | KSCN |
| B | Na | BaCl2 | FeO | KSCN |
| C | NaOH | Ba(NO3)2 | 锌粉 | KSCN |
| D | Na2O2 | MgCl2 | Fe | KSCN |
试题篮