题型:综合题 题类:常考题 难易度:困难
浙南名校联盟2019-2020学年高三上学期化学第一次联考试卷
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H1=-534kJ·mol-1
1/2H2(g)+1/2F2(g)=HF(g) △H2=-269kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-484kJ·mol-1
则该条件下N2H4(g)和F2(g)反应的热化学方程式为:。
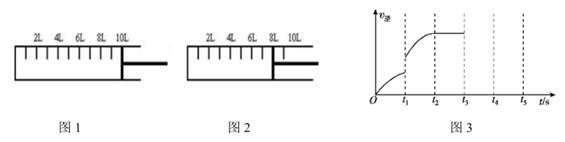
①下列表述能说明反应已达平衡的是。
A.活塞不再移动
B.容器内压强不再改变
C.容器内气体密度不再改变
D.容器内气体的平均相对分子质量不再改变
②试计算该条件下反应的平衡常数:。
③已知某次反应过程中逆反应速率随时间的变化图如图3所示。在t1时改变了某一种条件,则改变的条件可能是。
①下列说法正确的是。
A.已知该反应在较低温度下能自发进行,说明ΔS=0
B.加入催化剂,可降低反应的活化能和焓变,从而加快反应的速率
C.活化分子有效碰撞理论中,活化能指活化分子的平均能量与非活化分子平均能量的差值
D.在一定温度下,向恒容密闭容器中充入物质的量之比为1:3的NO和O3 , 达到平衡时转化率为a。
再充为入了1:3探的究NO和O3 , 转化率不变
②为了探究臭氧投加量对NO氧化脱除的影响,对一定时间内O3/NO的物质的量比值与NO脱除率进行了研究,结果如图4所示。
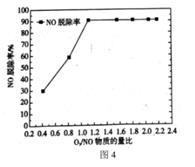
当O3/NO的物质的量比值小于1.1时,NO的脱除率随物质的量比的增大快速升高的原因可能是:。
请在图5中画出不同温度下,反应都经10min,NO的转化率曲线示意图。
试题篮