在一容积为2L的密团容器内加入0.2molN2和0.6molH2 , 在一定条件下发生如下反应:  N2(g)+
N2(g)+  H2(g)
H2(g)  NH3(g)
NH3(g)①该反应的平衡常数的表达式是:{#blank#}1{#/blank#}。
②反应中氨气的浓度的变化情况如图所示,计算从反应开始到平衡时,平均反应速率v(H2)={#blank#}2{#/blank#}。
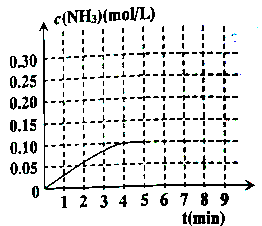
③判断该反应达到平衡状态的标志是{#blank#}3{#/blank#}。
a.N2和NH3浓度相等
b.NH3百分含量保持不变
c.容器中气体的压强保持不变
d.NH3的生成速率与H2的消耗速率相等
e.容器中混合气体的密度保持不变
④反应达平衡后,第5分钟末,保持其它条件不变,仅改变反应温度,则NH3的物质的量浓度不可能为{#blank#}4{#/blank#}。
a.0.2mol/L
b.0.12mol/L
c.0.10mol/L
d.0.08mol/L
⑤在第5分钟末,将容器体积缩小一半后,若在第8分钟末达到新平衡(此时NH3浓度约为0.25mol/L),请在上图中画出从第5分钟末开始,再达到新平衡时NH3浓度变化曲线。{#blank#}5{#/blank#}