题型:综合题 题类:常考题 难易度:普通
湖北省天门市、仙桃市、潜江市2017-2018学年高二下学期化学期末考试试卷
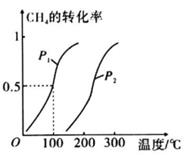
①已知压强为p1 , 100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为。
②图中的p1 p2(填“<”“>”或“=”),100℃时平衡常数为。
③在其他条件不变的情况下降低温度,重新达到平衡时H2体积分数将(填“增大”“减小”或“不变”)
①该反应的△H0,△S0(填“<”“>”或“=”)
②若容器容积不变,下列措施可提高H2转化率的是。
A.升高温度
B.将CH3OH(g)从体系中分离
C.再充入2 molCO和2molH2
D.充入He,使体系总压强增大
试题篮