题型:实验探究题 题类:模拟题 难易度:普通
试题来源:北京市朝阳区2020年高考化学模拟试卷
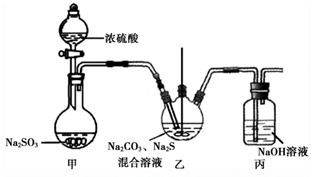
已知:2Na2S + 3SO2 = 2Na2SO3 + 3S↓ 、Na2SO3 + S = Na2S2O3
①甲中发生反应的化学方程式为1。
②实验过程中,乙中的澄清溶液先变浑浊,后变澄清时生成大量的Na2S2O3。一段时间后,乙中再次出现少量浑浊,此时须立刻停止通入SO2。结合离子方程式解释此时必须立刻停止通入SO2的原因:2。
③丙中,NaOH溶液吸收的气体可能有3。


已知:I. Cu(NH3)42+=Cu2++4NH3;
II. Cu2+在碱性较强时受热会生成CuO沉淀。
①将金矿石浸泡在Na2S2O3、Cu(NH3)42+的混合溶液中,并通入O2。浸金反应的原理为:i.Cu(NH3)42+
+ Au + 2S2O32− Cu(NH3)2+ + Au(S2O3)23−+ 2NH3
ii.4Cu(NH3)2+ + 8NH3+ O2 + 2H2O = 4Cu(NH3)42+ + 4OH−
浸金过程Cu(NH3)42+起到催化剂的作用,金总反应的离子方程式为:1。
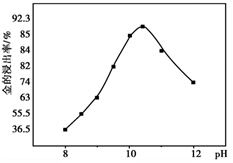
② 一定温度下,相同时间金的浸出率随体系pH变化曲线如如图,解释pH>10.5时,金的浸出率降低的可能原因2。(写出2点即可)



试题篮