修改时间:2021-05-20 浏览次数:90 类型:月考试卷
A  B
B ![]() C
C ![]() D
D  E
E ![]() F
F 
①正确的连接顺序:A—F—E— — — —尾气处理。(填字母)
②装置A的烧瓶中盛放的物质是(填名称),C装置的作用是 。
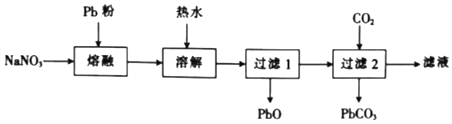
①“熔融”时用Pb粉代替铅粒的目的是。
②由“过滤2”的滤液得到NaNO2晶体还需经过的具体操作为、、过滤、用乙醇洗涤后干燥。
①取少量NaNO2溶液于试管中,滴入盐酸酸化,再加入KI和淀粉溶液,振荡,溶液变蓝,说明NaNO2具有(填“氧化性”或“还原性”)。
②向酸性KMnO4溶液中滴入NaNO2溶液,溶液紫色逐渐褪去,发生反应的离子方程式为(MnO4-被还原为Mn2+)。

已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ∆H=-49.5kJ/mol
则反应CO2(g)+2H2(g)=HCHO(g)+H2O(g) ∆H=kJ/mol

①按 =2投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。则a (填“>”或“<”)0;压强p1、p2、p3由小到大的关系是。

②在温度为T1℃,向某恒容密闭容器中充入H2和CO发生上述反应,起始时c(H2)=c(CO)=2.0mol/L。达到平衡时,CO的转化率为图中的M点对应的转化率,则在该温度下,对应的N点的平衡常数为(保留3位有效数字)。
|
CO浓度(mol/L) |
H2浓度(mol/L) |
逆反应速率(mol·L-1·min-1) |
|
0.1 |
c1 |
8.0 |
|
c2 |
c1 |
16.0 |
|
c2 |
0.15 |
6.75 |
由上述数据可得该温度下,c2=,该反应的逆反应速率常数k=L3∙mol-3∙min-l。
A. ![]()
B. ![]()
C. ![]()
D. ![]()
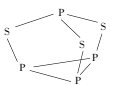
①P4S3分子中硫原子的杂化轨道类型为。
②每个P4S3分子中含有的孤电子对的数目为对。

|
碳酸盐 |
MgCO3 |
CaCO3 |
SrCO3 |
BaCO3 |
|
热分解温度/℃ |
402 |
900 |
1172 |
1360 |
|
金属阳离子半径/pm |
66 |
99 |
112 |
135 |

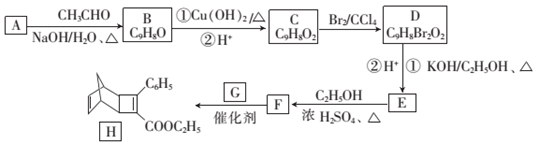
已知:①RCHO+CH3CHO RCH=CHCHO+H2O
② ![]()
回答下列问题:
试题篮