修改时间:2024-11-06 浏览次数:180 类型:高考模拟
①除铁滤池经过曝气3~7天后,滤料表面形成色物质,其成分是Fe(OH)3 , 使得溶液中Fe2+含量迅速下降,其作用过程如图所示。

②将过程ii的离子方程式补充完整:。
过程i:Fe2++Fe(OH)3=[Fe(OH)2OFe]++H+
过程ii:4[Fe(OH)2OFe]+++10H2O=+
③有利于提高过程ii反应速率的措施是(填序号)。
A.降低温度 B.通入足量O2 C.搅拌
向除锰滤池中加入ClO2将Mn2+氧化为MnO2 , 随着反应进行,滤池溶液的pH(填“变大”“变小”或“不变”)。
H2S(g)=H2(g)+S(s) ΔH1
已知:i.2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH2
ii.S(s)+O2(g)=SO2(g) ΔH3
①利用ΔH2和ΔH3计算ΔH1时,还需要利用反应的ΔH。
②直接加热分解H2S转化率低,科学家发现MoS2可以催化H2S分解制取氢气和硫磺,多孔陶瓷膜可以使氢气选择性分离。科学家使用沉积有MoS2的多孔陶瓷膜装置进行反应的原因有。
为避免硫磺沉积在阳极,将氧化吸收和电解制氢过程分开进行,装置如图所示。氧化吸收器中为Fe2(SO4)3溶液,电解反应器中,以石墨为阳极,以Pt为阴极,中间用质子交换膜隔开。
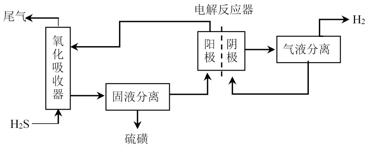
①氧化吸收器中反应的离子方程式为。
②电解反应器中,阴极的电极反应式为。
③电解反应器的作用是(写出2点)。

已知:ⅰ.Pb2O3 ![]() Pb3O4
Pb3O4 ![]() PbO
PbO
ⅱ.CdSO4易溶于水,热稳定性好
ⅲ.PbSO4(s)+2Cl-(aq) PbCl2(s)+SO42-(aq)
PbCl2(s)+2Cl-(aq) PbCl42-(aq)
ⅳ.Pb(OH)2为两性氢氧化物
|
焙烧温度/℃ |
各元素的去除率/% |
酸料比/(mL/g) |
各元素的去除率/% |
||
|
Pb |
Cd |
Pb |
Cd |
||
|
100 |
2.57 |
56.63 |
0.3 |
2.57 |
74.12 |
|
200 |
2.62 |
89.30 |
0.4 |
2.67 |
85.10 |
|
500 |
2.67 |
96.98 |
0.5 |
2.72 |
92.48 |
|
600 |
2.87 |
95.42 |
0.6 |
2.67 |
96.98 |
|
900 |
2.88 |
40.15 |
0.7 |
2.65 |
95.13 |
应选择的焙烧温度和酸料比为。
Cd去除率随温度升高先增大后减小的原因可能为。
+- 
已知:i.HC CH+

ii.R—NO2 ![]() R—NH2
R—NH2
iii.R1—NH2+ ![]() +HCl
+HCl
①能发生银镜反应
②核磁共振氢谱只有两组吸收峰


A中发生反应的化学方程式是。
|
序号 |
试管 |
操作 |
现象 |
|
① |
2 mLB中溶液 |
加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 |
不变蓝 |
|
② |
2 mLB中溶液 |
滴加几滴H2SO4至pH=5,加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 |
变蓝 |
|
③ |
2 mLH2O |
滴加几滴H2SO4至pH=5,加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 |
不变蓝 |
实验③的目的是。
|
装置 |
操作 |
现象 |
|
| 取10 mL1 mol/LNaNO2溶液于试剂瓶中,加入几滴H2SO4酸化,再加入10 mL1 mol/LFeSO4溶液,迅速塞上橡胶塞,缓缓通入足量O2。 | i.溶液迅速变为棕色; ii.溶液逐渐变浅,有无色气泡产生,溶液上方为浅红棕色。 iii.最终形成棕褐色溶液。 |
资料:i.[Fe(NO)]2+在溶液中呈棕色。
ii.HNO2在溶液中不稳定,易分解产生NO和NO2气体。
溶液迅速变为棕色的原因是。
资料:充分反应后,Fe2+全部转化为Fe(OH)x(SO4)y。

Fe(OH)x(SO4)y中x=(用含V1、V2的代数式表示)。
试题篮