修改时间:2020-03-31 浏览次数:186 类型:二轮复习

请填写下列空白:
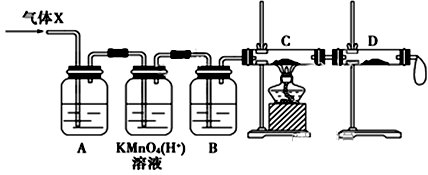
①酸性KMnO4溶液的作用是;B中添加的试剂是。
②装置C中所装药品为,可证实气体X中混有较多量某杂质气体的实验现象是。
① 已知上述反应中生成 1 mol NH3 放出 46 kJ 热量,该反应的热化学方程式为。
②该反应放热,但仍选择较高温度。其原因是。
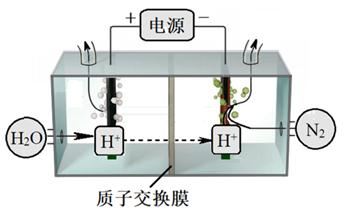
① 阴极生成氨的电极反应式为。
② 阳极氧化产物只有 O2。电解时实际生成的 NH3 的总量远远小于由 O2 理论计算所得 NH3 的量,结合电极反应式解释原因:。
![]()
已知:氮原子利用率是指目标产物中氮的总质量与生成物中氮的总质量之比
上述反应③的氮原子利用率为 66.7%。要使原料 NH3 转化为 NH4NO3 的整个转化过程
中氮原子利用率达到 100%,可采取的措施是
①KClO3与SO2在强酸性溶液中反应可制得ClO2 ,SO2被氧化为SO42- , 此反应的离子方程式为。
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl- , 该反应过程中氧化剂与还原剂的物质的量之比为。

在A装置中用固体二氧化锰与浓盐酸,在加热条件下制取氯气,写出反应的化学方程式;
②另一个副反应是2HCl+Ca(OH)2=CaCl2+2H2O,为避免此副反应的发生,可将装置如何改进。
将SO2通入水中形成“SO2-饱和H2SO3溶液”体系,此体系中存在多个含硫元素的平衡,写出其中1个平衡方程式:。
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如图1的实验:

实验结论:干白葡萄酒不能使品红溶液褪色,原因为:。
如图2是实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。

关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的方法是。
用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入图3装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能。M极发生的电极反应式为。

试题篮