题型:实验探究题 题类:常考题 难易度:普通
天津市红桥区2017-2018学年高二上学期化学期中考试试卷
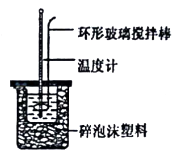
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
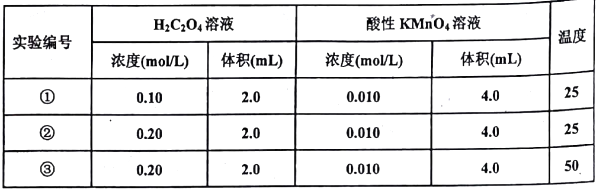
已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4 , 为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4) ≥。

|
| 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1) /℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
试题篮