题型:综合题 题类:模拟题 难易度:普通
湖南省郴州市2017-2018学年高考理综-化学二模考试试卷
C(s)+O2(g)=CO2(g) △H1= -393.5 kJ•mol-1
2H2(g)+O2(g)=2H2O(1) △H2= -571.6 kJ•mol-1
CH4(g)+2O2(g)-=CO2(g)+ 2H2O(1) △H3= -890.3 kJ•mol-1
则由天然气生产高级碳粉的热化学方程式为。
①用活性炭还原氮氧化物,可防止空气污染。向1L闭容器加入一定量的活性炭和NO,某温度下发生反应C(s)+2NO(g) N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
物质的量/mol 时间/min | NO | N2 | CO2 |
0 | 0.200 | 0 | 0 |
10 | 0.116 | 0.042 | 0.042 |
20 | 0.080 | 0.060 | 0.060 |
30 | 0.080 | 0.060 | 0.060 |
此温度下,该反应的平衡常数K=(保留两位小数)。10-20min内,NO的平均反应速率为;若30min后升高温度,达到新平衡时,容器中c(NO)∶c(N2) ∶c(CO2)=2∶1∶1,则该反应的ΔH0(填“>”、“<”或“=”)。
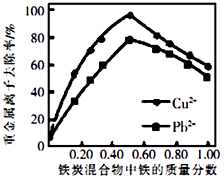
②活性炭和铁屑混合可用于处理水中污染物。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示。当混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+ , 其原因是;当混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是。
试题篮