题型:实验探究题 题类:模拟题 难易度:普通
2017年山西省吕梁市孝义市高考化学考前热身试卷 ,
已知:H2的燃烧热为285.8kJ•mol﹣1
N2(g)+2O2(g)═2NO2(g)△H=+133kJ•mol﹣1
H2O(g)═H2O(l)△H=﹣44kJ•mol﹣1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:.
向2L密闭容器中加入2molCO2和6molH2 , 在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)⇌CH3OH(l)+H2O(l)
①该反应自发进行的条件是(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是.(填字母)
a.混合气体的平均式量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1molCO2生成的同时有3mol H﹣H键断裂
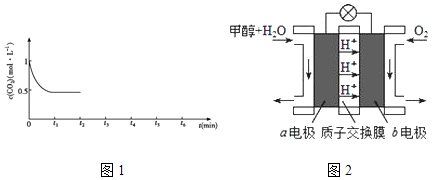
③CO2的浓度随时间(0~t2)变化如图1所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2浓度随时间的变化.
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I) K(II)(填“>”“<”或“=”下同);平衡时CH3OH的浓度c(I) c(II).
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=.在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,则T1T2(填“>”、“<”或“=”).若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡移动(填“正向”“逆向”或“不”).
①电极2的电极反应式是;
②在标准状况下,当电极2室有11.2L CO2反应. 理论上电极1室液体质量(填“增加”或“减少” g.
试题篮