题型:综合题 题类:常考题 难易度:普通
浙江省宁波十校2019-2020学年高三下学期化学3月月考试卷

在B点条件下,下列叙述能说明上述反应能达到化学平衡状态的是__。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;用P1或P2或P3表示)。
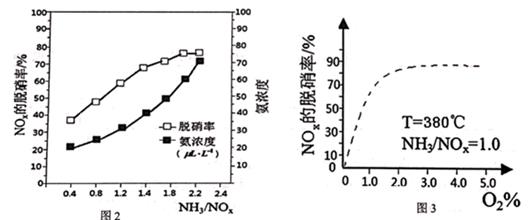 ①图2中,最佳氨氮比为2.0,理由是 。
①图2中,最佳氨氮比为2.0,理由是 。
②请在图3中,用实线画出不使用催化剂情况下(其他条件完全相同)的图示。
铁及碳的化合物在社会生产、生活中有着广泛的应用.请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一.
已知:①Fe3O4(s)+4C(s)⇌3Fe(s)+4CO(g)△H=+646.0kJ•mol﹣1
②C(s)+CO2(g)⇌2CO(g)△H=+172.5kJ•mol﹣1
则Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g)△H={#blank#}1{#/blank#} .
(2)反应Fe(s)+CO2(g)⇌FeO(s)+CO(g)△H的平衡常数为K,在不同温度下,K值如下:
温度/K | 973 | 1173 | 1373 | 1573 |
K | 1.47 | 2.15 | 3.36 | 8.92 |
①从表中数据可推断,该反应是{#blank#}2{#/blank#} (填“放热”或“吸热”)反应.
②温度为973K时,在某恒容密闭容器中发生上述反应.下列有关说法能说明该反应已达到平衡状态的是{#blank#}3{#/blank#} (填字母).
A.c(CO2)=c(CO) B.v正(CO2)=v逆(CO)
C.体系压强不变 D.混合气体中c(CO)不变
(3)如图图1、2表示反应:H2(g)+CO2(g)⇌CO(g)+H2O(g)△H>0有关量与反应时间之间的关系:

①图2中若t1=0.5min,则0~t1时间段内,H2O的平均反应速率v(H2O)={#blank#}4{#/blank#} mol•L﹣1•s﹣1 .
②图1中t2时刻改变的条件是{#blank#}5{#/blank#} (任写两种,下同);图2中t2时刻改变的条件是{#blank#}6{#/blank#} .
(4)水煤气中的CO和H2均可作为燃料电池的燃料.若在某燃料电池一极通入CO,另一极通入O2和CO2 , 熔融碳酸钠作为电解质,工作时负极反应式为{#blank#}7{#/blank#} ;若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为{#blank#}8{#/blank#} L
(标准状况下).
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
试题篮