题型:综合题 题类:常考题 难易度:困难
北京市101中学2019-2020学年高三下学期化学第三次月考试卷
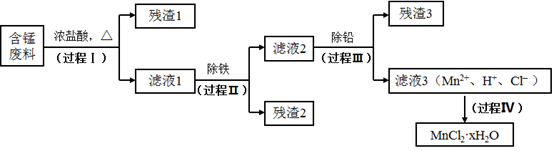
资料a.Mn的金属活动性强于Fe,Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b.生成氢氧化物沉淀的pH
| Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 8.1 | 6.5 | 1.9 |
| 完全沉淀时 | 10.1 | 8.5 | 3.2 |
注:金属离子的起始浓度为0.1mol·L-1
①MnO2与浓盐酸反应的离子方程式是。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入铁氰化钾溶液,无蓝色沉淀生成;另取少量滤液1于试管中,。
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3++2Cl-
b.4Fe2++O2+4H+=2Fe3++2H2O
c.......
写出c的离子方程式:。
ⅰ.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ⅱ.焙烧法:将滤液1浓缩得到的固体于290℃焙烧,冷却,取焙烧物......。
已知:焙烧中发生的主要反应为2FeCl3+3O2=2Fe2O3+3Cl2 , MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在之间。
②补全ⅱ中的操作:。
③两种方法比较,氨水法除铁的缺点是。
| 编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| (1) | 己烷(己烯) | 溴水 | 分液 |
| (2) | 淀粉溶液(NaCl) | 水 | 渗析 |
| (3) | CH3CH2OH(CH3COOH) | CaO | 蒸馏 |
| (4) | CO2(SO2) | 碳酸钠溶液 | 洗气 |

已知:①有关氢氧化物开始沉淀和沉淀完全的pH如表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.6 | 9.7 | 9.2 |
②常温下CaF2难溶于水,微溶于无机酸
试题篮