(1)汽车发动机工作时会引发N2和O2反应,生成NOx等污染大气.其中生成NO的能量变化示意图如图1:
①该反应的热化学方程式为
 {#blank#}1{#/blank#} .
{#blank#}1{#/blank#} .
②根据图1所示,只改变条件R,当N2的转化率从a3到a1时,平衡常数K{#blank#}2{#/blank#} .
A.可能增大 B.一定不变 C.可能不变 D.可能减小 E.增大、减小、不变均有可能
(2)尿素(又称碳酰胺)是含氮量最高的氮肥,工业上利用CO2和NH3在一定条件下合成尿素的反应分为:
第一步:2NH3(g)+CO2(g)⇌H2NCOONH4(氨基甲酸铵) (l)
第二步:H2NCOONH4(l)⇌H2O(g)+H2NCONH2(l)
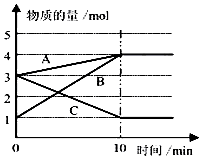
某实验小组模拟工业上合成尿素的条件,在一体积为500L的密闭容器中投入4mol氨和1mol二氧化碳,验测得
反应中各组分的物质的量随时间的变化如图2所示:
①合成尿素总反应的快慢由第{#blank#}3{#/blank#} 步反应决定.
②反应进行到10min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)={#blank#}4{#/blank#} mol/(L•min).
③由氨基甲酸铵和CO2曲线变化可得出关于浓度变化和平衡状态的两条结论是:a.{#blank#}5{#/blank#} ;b{#blank#}6{#/blank#} .

×100%】,请写出计算过程,计算结果保留1位小数)