题型:综合题 题类:模拟题 难易度:普通
①该反应的离子方程式为 .
②该反应在25﹣50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,试分析其原因为 ..
Ⅱ,配位浸出
反应原理为:CuFeS2+NH3•H20+O2+OH﹣→Cu(NH3)42++Fe2O3+SO42﹣+H20(未配平)
为稳定浸出液的pH,生产中需要向氨水中添加NH4Cl,构成NH3 . H2O﹣NH4Cl缓冲溶液.某小组在实验室对该缓冲体系进行了研究:25℃时,向amol.L﹣l的氨水中缓慢加入等体积0.02mol.L﹣l的NH4Cl溶液,平衡时溶液呈中性.则NH3 . H2O的电离常数Kb= (用含a的代数式表示);滴加NH4Cl溶液的过程中水的电离平衡 (填“正向”、“逆向”或“不”)移动.
Ⅲ,生物浸出
在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示.

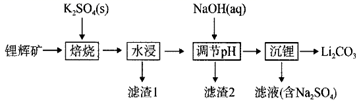
已知:① 的
,
的
,溶液中离子浓度小于
时,即认为沉淀完全。
②碳酸锂在不同温度下的溶解度如表所示:
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
回答下列问题:
试题篮