题型:综合题 题类:常考题 难易度:困难
安徽省合肥市2020年高三化学一模试卷
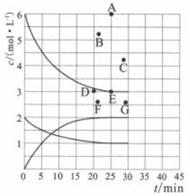
①下列能说明反应达到平衡状态的是(选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4.00 mol N2和12.00 mol H2 , 则反应刚达到平衡时,表示c(H2)~t的曲线上相应的点为(选填字母)。
2NO2 N2O4(g) △H=-56.9 kJ·mol-1
测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:

①计算0~20min时,v(N2O4)=。
②已知该反应v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时, ;改变温度至T1时,k1=k2 , 则T1373K(填“>”“<”或“=”)。
物 质 | 需加入的试剂 | 有关离子方程式 |
①HNO3(H2SO4) | ||
②Cu(Fe) | ||
③NaCl(Na2CO3) |
试题篮