题型:综合题 题类:常考题 难易度:困难
湖北省公安县第三中学2018-2019学年高二上学期化学12月月考试卷

①电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为
②MnO2可做超级电容器材料,电解MnSO4溶液可制得MnO2 , 其阳极的电极反应式
①以上酸碱中必为弱电解质的是
②比较两种酸HX和HY的酸性强弱 >
倍。

|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅-硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
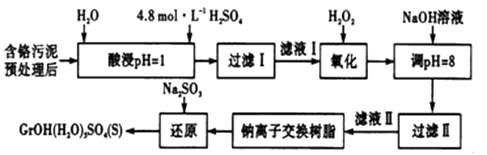
常温下,部分阳离子以氢氧化物形式沉淀时,溶液的pH如下:
|
阳离子 |
Fe3+ |
Mg2+ |
Al3+ |
|
开始沉淀时的pH |
2.7 |
— |
— |
|
沉淀完全时的pH |
3.7 |
11.1 |
8 |
其中硫酸浸取液中的金属离子主要是Cr3+ , 其次是Fe3+、Al3+、Ca2+和Mg2+。
试题篮