修改时间:2023-08-23 浏览次数:293 类型:单元试卷
①取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液;
②取实验①滤出的白色沉淀,向其中加入足量的盐酸,沉淀全部溶解,并产生无色气体;
③取实验①得到的滤液,向其中通入CO2 , 产生白色沉淀。
根据以上实验现象,判断白色粉末。下列结论不正确的是( )
|
1a溶液蓝色……………………………………………A 1b溶液无色……………………………………………2 2a滴加紫色石蕊试剂呈红色…………………………B 2b滴加紫色石蕊试剂呈紫色…………………………C 2c滴加紫色石蕊试剂呈蓝色…………………………3 3a滴加氢氧化钡溶液有沉淀产生……………………D 3b滴加氢氧化钡溶液无沉淀产生……………………E |
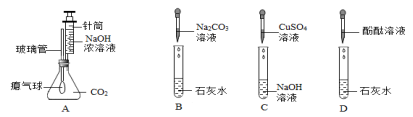
猜想一:只含有NaOH;猜想二:含有NaOH、Na2CO3;猜想三:含有NaOH、Ca(OH)2同学们取少量B试管中的清液分别置于甲、乙两支试管中,进行探究:
|
实验操作 |
实验现象 |
结论 |
|
在试管甲中滴加碳酸钠溶液 |
不产生白色沉淀 |
猜想三错误 |
|
在试管乙中滴加足量稀盐酸 |
|
猜想二正确 |
【进行猜想】

猜想Ⅰ:该溶液的溶质是NaCl;猜想Ⅱ:该溶液的溶质是NaOH;
猜想Ⅲ:该溶液的溶质是Na2CO3;猜想 IV:该溶液的溶质是NaHCO3。
|
物质 |
NaCl |
NaOH |
Na2CO3 |
NaHCO3 |
|
常温下的溶解度/g |
36 |
109 |
21.5 |
9.6 |
|
常温下稀溶液的pH |
7 |
13 |
11 |
9 |
从物质的相关信息可知,该溶液的溶质不是NaHCO3 , 因为常温下NaHCO3溶液溶质的质量分数最大是(精确到0.1%)。

①产生白色沉淀的化学方程式是。
②实验可以判断原无色溶液中含有的溶质有。
【查阅资料】聚乙烯燃烧生成CO2和H2O;聚氯乙烯燃烧除了生成CO2和H2O之外,还会有HCl气体产生。
【实验探究】小明将以下实验装置按甲图中ABCD顺序连接好,然后进行探究。

【实验反思】连接实验装置时,能否将装置C、D顺序调换?请简述。
答: 理由是。
【实验结果】
|
实验前 |
实验后 |
|
|
B装置的质量/g |
213.6 |
220.8 |
|
C装置的质量/g |
200.2 |
217.8 |

聚乙烯中是否含有氧元素(填“有”或“无”);碳氢元素的质量比为.

①实验开始时,排尽装置中的空气,防止加热时发生爆炸
②停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中
③将装置中的CO2送入NaOH溶液中
①取50克样品加入足量的蒸馏水,充分搅拌静置后,将浸出液全部转移到烧杯中;
②在烧杯中加入足量的CaCl2溶液,得到沉淀;
③将沉淀过滤、洗涤、烘干后得到5克固体。
求该样品中碳酸钾的质量分数。(杂质不发生化学反应,K2CO3+CaCl2=2KCl+CaCO3↓ )
|
项 目 |
实验1 |
实验2 |
实验3 |
实验4 |
实验5 |
|
加入稀盐酸的质量/g |
0 |
50 |
50 |
50 |
50 |
|
烧杯与烧杯中物质的总质量/g |
70.00 |
117.5 |
165.0 |
M |
263.4 |
根据实验数据回答问题:
①向少量废液中滴加石蕊试液,试液变红色。
②向10mL废液中滴加Na2CO3溶液,测得沉淀总质量与加入的Na2CO3溶液总质量的关系如下表所示:
|
第一次测量 |
第二次测量 |
第三次测量 |
第四次测量 |
|
|
加入Na2CO3溶液的总质量/g |
10 |
20 |
30 |
40 |
|
生成沉淀总质量/g |
a |
0.5 |
1.5 |
2 |
请分析计算:
①取200g混合溶液加入足量的AgNO3溶液,经过滤、洗涤、干燥、称量,得到143.5g AgCl固体;
②另取原混合溶液各200g与含有杂质的废铁屑反应(杂质不溶于水,也不参与反应),共做了五组实验,其实验数据如表。
|
实验组别 |
一 |
二 |
三 |
四 |
五 |
|
混合溶液质量/g |
200 |
200 |
200 |
200 |
200 |
|
铁屑质量/g |
6 |
9 |
12 |
15 |
18 |
|
析出铜的质量/g |
6.4 |
9.6 |
m |
16 |
16 |
请分析计算:
试题篮