修改时间:2024-07-13 浏览次数:289 类型:期末考试

实验记录如下:
| 实验序号 | 实验操作 | 实验现象 |
| I | 向A装置中通入一段时间的SO2气体。 | A中黄色溶液迅速变成深红棕色,最终变为浅绿色。 |
| II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液。 | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀。 |
| III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a。 | A中浅绿色溶液最终变为黄色。 |
| IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中注入空气。 | 溶液变为红色;液面上方有少量红棕色气体生成。 |
请回答下列问题:

已知生成氢氧化物沉淀的pH如下表所示:
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀 | 4.2 | 6.5 | 1.5 |
| 完全沉淀 | 6.7 | 9.7 | 3.7 |

2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH
若① N2(g)+O2(g) 2NO(g) ΔH1= +180.5 kJ•mol-1
② CO(g) C(s)+1/2O2(g) ΔH2= +110.5 kJ•mol-1
③ C (s)+O2(g) CO2(g) ΔH3= -393.5 kJ•mol-1
则ΔH=kJ•mol-1。

①该反应的化学平衡常数表达式:K=。
②图中A点时,SO2的转化率为
③计算SO2催化氧化反应在图中B点的压强平衡常数K=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
④若在T2℃,其他条件不变的情况下测得压强的变化曲线如图所示,则T1T2(填“>”、“<”、“=”);其中C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正) vA(逆) (填“>”、“<”、“=”)。
|
元素 |
Cl |
Cu |
|
电负性 |
3.2 |
1.9 |

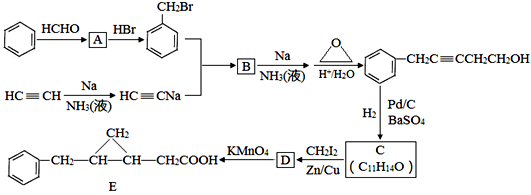
回答下列问题:
a.苯和乙炔都能使溴水褪色,前者为化学变化,后者为物理变化
b.苯和乙炔在空气中燃烧都有浓烟产生
c.苯与浓硝酸混合,水浴加热55~60℃,生成硝基苯
d.聚乙炔是一种有导电特性的高分子化合物
试题篮