题型:实验探究题 题类:模拟题 难易度:困难
江苏省苏州常熟市2016-2017学年九年级下学期化学4月调研测试(一模)考试试卷
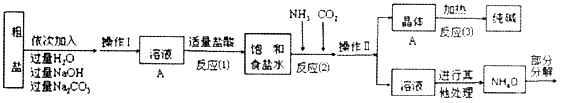
【查阅资料】
①无水硫酸铜是白色固体,吸水变蓝。
②生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质。
③生产原理:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。
④氯化铵分解的化学方程式是NH4Cl=NH3↑+HCl↑。
⑤部分生产流程如下图所示:
【问题讨论】
②操作Ⅱ的名称为。
③写出加入NaOH溶液所发生反应的化学方程式。
④流程中Na2CO3溶液的作用是除去粗盐中的。
①晶体A受热分解的化学方程式为 。
②设计实验检验纯碱样品中是否混有晶体A,请完成下表(从下列装置中选择):
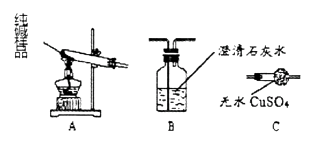
选择的装置 | 实验现象 | 实验结论 |
样品不含晶体A |
取纯碱样品加水溶解,向该溶液中加入过量稀HNO3 , 再滴加AgNO3溶液,有白色沉淀。产生沉淀的方程式为,由此确定纯碱样品含有杂质NaCl。
同学们为了测定该纯碱样品的纯度,设计了如下实验:

①氯化钡溶液过量的目的是。
②判断滤渣是否洗干净,可向最后的洗出液中滴加,然后观察现象判断。
A.氯化钡溶液 B.稀硫酸 C.稀盐酸 D.碳酸钾溶液
③根据实验数据,计算样品中碳酸钠的质量分数为。(精确到0. 1 % )
试题篮