题型:多选题 题类:常考题 难易度:普通
实验探究物质的性质或变化规律a40题

序号 | 化学反应事实 | 决定化学反应 能否发生的因素 |
A | 铁丝在空气中很难燃烧,而在氧气中能剧烈燃烧 | 反应物浓度 |
B | 常温下氢氧混合气体不反应,而点燃时可能发生爆炸 | 反应物温度 |
C | 碳和氧气反应时,氧气的量不同生成物也可能不同 | 反应物的量 |
D | 煤在空气中很难被点燃,纸张在空气了中较易被点燃 | 反应物的种类 |
H2C2O4•2H2O 3H2O+CO↑+CO2↑
草酸晶体的其他性质如下:
熔点 | 沸点 | 溶解度(0℃) | 热稳定性 | 与碱反应 |
101℃~102℃ | 150℃~160℃ | 3.54g | 100.1℃失去结晶水,175℃分解成CO2 , CO,H2O | 与Ca(OH)2反应产生白色沉淀(CaC2O4) |
该小组设计的装置如下:图1是加热分解装置,图2是验证分解产物的装置.
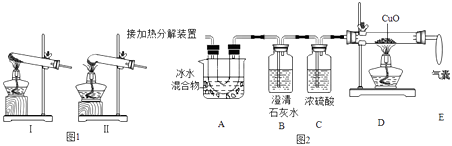
该小组称量纯碱草酸晶体的质量为10.0g,完全反应后A装置增加的质量为ag,B装置增加的质量为bg,D装置减少的质量为dg.实验过程中还能够观察到A中有液体和晶体.
小军发现小红将三个滴瓶中的三支滴管混用,认为小红实验操作不规范,滴瓶中的试剂会因此受污染而无法再次使用,学习小组就盛有NaCl溶液的滴瓶是否被另外两种试剂污染进行了如下探究.
(提出问题)该滴瓶中溶质的成分是什么?
(提出猜想)通过分析,提出如下猜想:
猜想Ⅰ溶质成分只有NaCl;
猜想Ⅱ溶质成分为NaCl和NaOH;
猜想Ⅲ溶质成分为{#blank#}1{#/blank#};
猜想Ⅳ溶质成分为NaCl、NaOH和Na2SO4 .
(实验探究)为证明猜想,小军设计了如下实验方案,请你一起完成下列实验报告;
|
实验操作 |
实验现象 |
结论或解释 |
|
⑴取该滴瓶内溶液少许于试管中,向试管中加入适量BaCl2溶液 |
产生白色沉淀 |
该反应的化学 方程式为{#blank#}2{#/blank#} |
|
⑵将上述反应后的混合液过滤,取滤液于另一支试管中,向该试管中加入{#blank#}3{#/blank#} |
{#blank#}4{#/blank#} |
证明猜想Ⅳ成立 |
(实验反思)小红和小明非常赞赏小军的实验方案,该实验方案同时证明了猜想Ⅱ、Ⅲ不成立.
试题篮