修改时间:2021-09-02 浏览次数:120 类型:一轮复习
![]()

①废水在加入金属X前需进行过滤,目的是将其中性杂质除去.进行过滤的操作所需的仪器有:、、、。(请从下图中选择合适仪器,并用仪器名称填写).

②金属X是,其加入废水后发生反应的化学方程为;溶液Y是,利用其除去铜中杂质,有关反应的化学方程式为.
③从滤液中获取硫酸亚铁晶体的操作方法是
在通常状况下,氯气是一种黄绿色气体,密度比空气大,易溶于水,广泛应用于实际生产和生活中.在工业上,制取氯气的主要工艺流程如下:


实验步骤:
①打开弹簧夹a,先对装置A/B/C(已接入)通入空气一会
②关闭弹簧夹a,接上装置D和E,此时D装置的总质量为m1;
③打开弹簧夹c,把硫酸滴入样品中,直到B中不再有气泡冒出后,再次测量D装置的总质量为m2


①食盐晶体不纯 ②配制溶液的烧杯用少量蒸馏水润洗
③用量筒量取水时俯视读数 ④将配好的溶液转移到细口瓶时,有部分洒出
查阅资料:①CaCl2+H2O2+2NH3·H2O+6H2O==CaO2·8H2O↓+2NH4Cl;
②过氧化钙晶体(CaO2·8H2O)在0℃时稳定,但受热(如烘干过程中)容易逐渐失去结晶水,加热至130℃叫变为CaO2 , 加热至400~425℃叫完仝分解为CaO和O2。
【实验一】模拟工业制备过氧化钙晶体
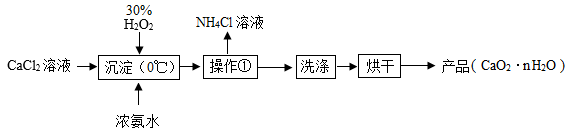
【实验二】对所得产品进行组成测定

a.该方案用下列装置完成本实验,装置的正确连接顺序是(填装置的字母编号,装置不重复使用)。

b.D装置中的反应完全后,需再次通入空气,其目的是。
(已知:NaHCO3+NaOH=Na2CO3+H2O)

该方案测得样品中NaHCO3的质量分数的表达式为(用字母表示)。
自来水厂净水过程的主要操作流程如图:
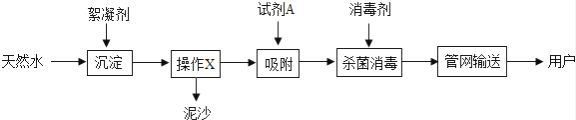
资料:常用的絮凝剂有明矾[KAl(SO4)•12H2O],消毒剂有液氯(Cl2)
回答下列问题:
液氯与水中杂质反应生成一些对人体有害的物质,例如三氯甲烷(CHCl3).三氯甲烷属于 (填“有机物”或“无机物”).
①在过滤操作中,需要用到的玻璃仪器有 (填序号)。
A.酒精灯、漏斗、玻璃棒 B.漏斗、玻璃棒、烧杯 C.酒精灯、试管、玻璃棒
②求实验中所用的稀盐酸溶质质量分数。(写出计算过程)

试题篮