A、B、C、D是原子序数依次递增的前四周期元素,A元素的正化合价与负化合价的代数和为零;B元素原子的价电子结构为nsnnpn;C元素基态原子s能级的电子总数比p能级的电子总数多1;D元素原子的M能层全满,最外层只有一个电子。请回答:
(1)、A 元素的单质为A2 , 不能形成A3或A4 , 这体现了共价键的性;B元素单质的一种空间网状结构的晶体熔点>3550℃,该单质的晶体类型属于;基态D原子共有种不同运动状态的电子。
(2)、A与C形成的最简单分子的中心原子杂化方式是
,该分子与D
2+、H
2O以2:1:2的配比结合形成的配离子是
(填化学式),此配离子中的两种配体的不同之处为
(填标号)。
①中心原子的价层电子对数 ②中心原子的孤电子对的对数 ③中心原子的化学键类型 ④VSEPR模型
(3)、1molBC—中含有的π键数目为;写出与BC-互为等电子体的分子和离子各一种、。
(4)、D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,其原 因是。
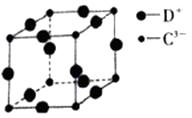
(5)、D
3C 具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D
+和C
3—半径分别为apm、bpm,D
+和C
3—都是紧密接触的刚性小球,则C
3—的配位数为
,晶体的密度为
g·cm
-3。