题型:综合题 题类:模拟题 难易度:普通
2017年北京市昌平区高考化学二模试卷
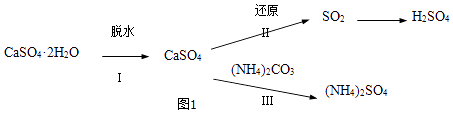
CaSO4•2H2O(s)=CaSO4• H2O(s)+
H2O(g)△H1=+83.2KJ•mol﹣1
CaSO4•2H2O(s)=CaSO4(s)+2H2O(l)△H2=+26KJ•mol﹣1
H2O(g)=H2O(l)△H3=﹣44KJ•mol﹣1
则反应CaSO4• H2O(s)=CaSO4(s)+
H2O(g)的△H4=KJ•mol﹣1 .
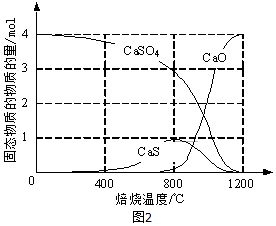
①CO作还原剂,改变反应温度可得到不同的产物.不同温度下所得固体成分的物质的量如图2所示.在低于800℃时还原产物为;1200℃时主要发生的反应的化学方程式为.
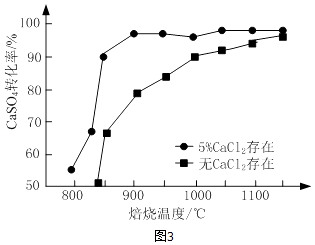
②高硫煤作还原剂,焙烧2.5小时,测不同温度下硫酸钙的转化率,如图3所示.CaCl2的作用是;当温度高于1200℃时,无论有无CaCl2 , CaSO4的转化率趋于相同,其原因是.
③以SO2为原料,工业生产硫酸的化学方程式.
试题篮