题型:实验探究题 题类:模拟题 难易度:普通
2017年北京市西城区高考化学二模试卷
I. 向软锰矿浆中通入SO2 , 锰、铁、铝、铅元素以离子形式浸出,测得浸出液的pH<2.
II. 向浸出液中加MnO2 , 充分反应后,加入石灰乳,调溶液pH=4.7.
III.再加入阳离子吸附剂,静置后过滤.
IV.滤液蒸发浓缩,冷却结晶,获得MnSO4晶体.
【资料】部分阳离子形成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
和少量CaSO4 .
①电解MnSO4溶液的离子方程式是
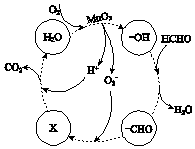
②高活性MnO2可用于催化降解甲醛,有关微粒的变化如图所示,其中X是,总反应的化学方程式是.

已知黄磷与少量Cl2反应生成PCl3 , 与过量Cl2反应生成PCl5 PCl3遇水会强烈水解生 成 H3PO3和HCl.遇O2会生成POCl3 , POCl3溶于PCl3 , PCl3、POCl3的熔沸点见下表:
|
物质 |
熔点/℃ |
沸点/℃ |
|
PCl3 |
﹣112 |
75.5 |
|
POCl3 |
2 |
105.3 |
请回答下列问题:
正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.

发生的反应如下:
CH3CH2CH2CH2OH CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g•cm﹣3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90﹣95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75﹣77℃馏分,产量2.0g.回答下列问题:
I.制备POCl3
采用氧气氧化液态的PCl3法,实验装置(加热及夹持装置省略)及相关信息如下:

物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | ﹣112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈水解为含氧酸和氯化氢,两者互溶 |
POCl3 | 2.0 | 106.0 | 153.5 |
试题篮