题型:综合题 题类:模拟题 难易度:普通
2017年北京市朝阳区高考化学二模试卷
温度/℃ | 200 | 300 | 400 |
K | 290 | 39 | 11.7 |
①下列分析正确的是.
a.水煤气变换反应的△H<0
b.增大压强,可以提高CO的平衡转化率
c.增大水蒸气浓度,可以同时增大CO的平衡转化率和反应速率
②以氨水为吸收剂脱除CO2 . 当其失去吸收能力时,通过加热使吸收剂再生.用化学方程式表示“吸收”、“再生”两个过程:.
实验Ⅰ | 实验Ⅱ | |
通入气体 | CO、H2 | CO、H2、H2O(g) |
固体产物 | Fe3O4、Fe | Fe3O4 |
结合化学方程式解释H2O(g)的作用:.
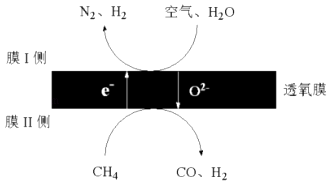
①起还原作用的物质是.
②膜Ⅰ侧发生的电极反应式是.
③膜Ⅰ侧所得气体 =3,CH4、H2O、O2反应的化学方程式是.
试题篮