题型:综合题 题类:常考题 难易度:普通
浙江省诸暨市2019-2020学年高三上学期化学第一次月考试卷
反应I CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206 kJ/mol
反应II CO(g)+H2O(g) CO2(g)+H2(g) △H2=-41 kJ/mol
副反应 CH4(g) C(s)+2H2(g) △H3=+75 kJ/mol
A.高温高压 B.低温低压 C.高温低压 D.低温高压
②某研究小组在一定条件下往恒温恒容的密闭容器中通入一定量的甲烷和水蒸气,实验过程中发现CO2的产率远大于CO的产率,请解释可能的原因。
①某恒容体系中,压强为1.3MPa,水/甲烷的物质的量之比为4,反应相同时间,H2的物质的量随反应温度的变化曲线如图所示。

下列说法正确的是
A.对反应I而言,KT1>KT2
B.水/甲烷的物质的量之比等于4,大于初始反应的化学计量数之比,有利于促进CH4的转化,同时也有利于CO转化为CO2
C.使用Ni做催化剂,可增加活化分子百分数,从而加快反应速率,其主要原因是提高分子自身所具有的能量
D.若控制其他条件不变,缩小体积,则CH4的平衡转化率将减小
②在某恒温体系中,体积为1L,水/甲烷的物质的量之比等于4,投入CH4的量为1mol,若仅发生上述一系列反应,一段时间后,测得CH4的转化率为a,其中生成CO的选择性(转化的CH4中,生成CO的百分含量)为b,CO2的浓度为c mol/L,求此时H2的物质的量浓度为,CO的物质的量浓度为

请写出通入甲烷-极的电极反应式为。
一定条件下反应A(g)+B(g)⇌C(g)△H<0达到平衡后,据下列图象判断:
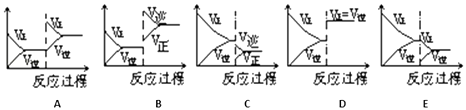
达到新的平衡对应的图象 (填写字母) | 平衡移动方向 (正反应、逆反应,不移动) | |
(i)使用催化剂 | {#blank#}1{#/blank#} | {#blank#}2{#/blank#} |
(ii)升温 | {#blank#}3{#/blank#} | {#blank#}4{#/blank#} |
(iii)降压 | {#blank#}5{#/blank#} | {#blank#}6{#/blank#} |
(iv)增加A的量 | {#blank#}7{#/blank#} | {#blank#}8{#/blank#} |
(v)减少C的量 | {#blank#}9{#/blank#} | {#blank#}10{#/blank#} |
试题篮