题型:实验探究题 题类:常考题 难易度:普通
江苏省扬州市2019-2020学年高一下学期化学期末考试试卷
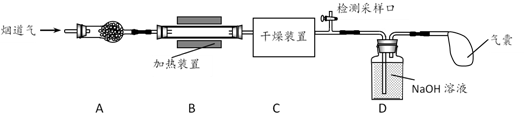
a.碱石灰 b.浓硫酸 c.五水合硫酸铜(CuSO4·5H2O)
①若反应后尾气无残留,则参加反应的NO2、NO物质的量比值为(填字母)。
a.≥1 b.≤1 c.任意值
②可使用适量酸性H2O2溶液,将溶液中的NO2-全部氧化为NO3- , 发生反应的离子方程式是。
步骤一、取适量(2)中H2O2处理后的溶液,调节pH至中性,蒸发浓缩,得到c(NO3-)为0.100mol·L-1的溶液甲。
步骤二、现量取50mL溶液甲,分别用金属铝、金属铁和铝铁合金在45℃、惰性气体氛围中对溶液乙进行氮脱除。
步骤三、重复实验2~3次,溶液中NO3-的残留情况与反应时间的关系如图所示。

①金属铝和金属铁在0~3h内,NO3-的脱除效率均很低,几乎没被脱除,其可能的原因是。
②0~3h内铝铁合金的氮脱除效率比金属铝、金属铁大得多,其可能的原因。
试题篮