A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大.元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道(能级);D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子.
(2)、B、C、D元素的第一电离能由大到小的顺序是.
(3)、B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是;B、C的这些氢化物的沸点相差较大的主要原因是.
(4)、A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是;1mol该分子中含有π键的数目是.
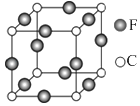
(5)、C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是
,C原子的配位数是
.