修改时间:2021-04-23 浏览次数:90 类型:二轮复习
| 弱酸 | HCOOH | HCN |
| 电离平衡常数 | Ka=1.77×10-4 | Ka=5×10-10 |

回答下列问题:
|
指示剂变色范围(pH) |
甲基橙(3.1~4.4) |
石蕊(5~8) |
酚酞(8.2~10.0) |
||||||
|
颜色 |
<3.1 |
3.1~4.4 |
>4.4 |
<5 |
5~8 |
>8 |
<8.2 |
8.2~10.0 |
>10.0 |
|
红 |
橙 |
黄 |
红 |
紫 |
蓝 |
无色 |
粉红 |
红 |
|
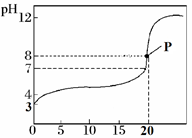
②滴定起始和终点的液面位置如图2所示,则消耗NaOH溶液的体积为mL。
③下列操作使滴定结果偏高的是。
a.滴定前,碱式滴定管未用NaOH溶液润洗
b.锥形瓶的待测液中加少量水稀释
c.碱式滴定管滴定前有气泡,滴定后无气泡
d.读数时,滴定前仰视,滴定后俯视
|
化学式 |
| | HClO |
| 电离平衡常数 | | | |
回答下列问题:

|
t/℃ |
0 |
10 |
20 |
25 |
40 |
50 |
90 |
100 |
|
Kw/10-14 |
0.134 |
0.292 |
0.681 |
1.01 |
2.92 |
5.47 |
38.0 |
55.0 |
由此推出:随着温度的升高,Kw的值;水的电离程度;水的电离平衡向移动,水的电离过程是过程。
|
纯水 |
加少量盐酸 |
加少量NaOH |
|
|
c(H+) |
1.0×10-7 mol·L-1 |
增大 |
|
|
c(OH-) |
1.0×10-7 mol·L-1 |
|
增大 |
|
c(H+)和c(OH-)大小比较 |
c(H+)=c(OH-) |
c(H+)c(OH-) |
c(H+) c(OH-) |
|
水的电离平衡移动方向 |
|
|
|
|
Kw值 |
1.0×10-14 |
|
|
综上所述,可得出如下结论:
①温度、均能影响水的电离平衡。
②Kw只受的影响,而与其他因素无关。

已知:①菱锰矿石主要成分是 MnCO3 , 还含有少量 Fe、Al、Ca、Mg 等元素;
②相关金属离子[c(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的 pH 如表:
| 金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
| 开始沉淀的 pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
| 沉淀完全的 pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
回答下列问题:


试题篮