修改时间:2024-07-13 浏览次数:205 类型:期中考试
| 时间 | 0 | 20 | 40 | 60 | 80 | 100 | |
| HI(g)的物质 的量分数 | T1 | 0 | 0.50 | 0.68 | 0.76 | 0.80 | 0.80 |
| T2 | 0 | 0.60 | 0.72 | 0.75 | 0.75 | 0.75 | |
下列说法正确的是( )
①取样溶于水,得澄清透明溶液
②样品溶液中滴加过量氯水,再滴加过量BaCl2溶液,得白色沉淀1,过滤,将滤液一分为二
③往其中一份滤液中加入CCl4 , 振荡,溶液分层,上层用淀粉-KI试纸检验呈蓝色,下层呈橙红色
④另一份滤液中加入过量的NaOH,得沉淀2,用盐酸完全溶解沉淀2,滴加Na2S溶液,可见淡黄色浑浊
下列判断错误的是( )
请回答:
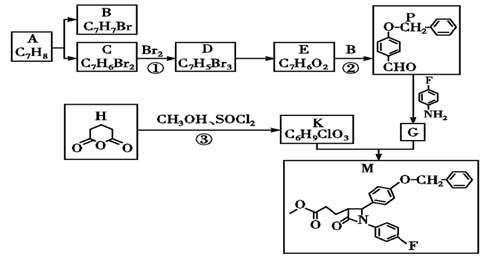
已知:Ⅰ. 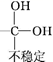
![]()
![]()
Ⅱ. ![]() +RNH2
+RNH2 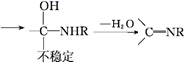
Ⅲ. 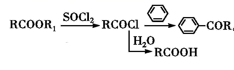 (R1为H或烃基)
(R1为H或烃基)
请回答:
①属芳香族化合物②能与酸反应③1H—NMR谱中出现3个峰
①该反应能自发进行的条件是(填“高温”、“低温”或“任意温度”)
②下列说法正确的是。
A.v正(H2)=2v逆(CO)时,反应达到化学平衡状态
B.达到平衡时CO与H2的转化率相等
C.恒温恒压,往原料气中通入少量稀有气体,CO的转化率会降低
D.该反应的正反应活化能大于逆反应活化能
③图1为温度对H2合成甲醇反应的影响,请从反应速率和平衡的角度分析725℃以后H2百分含量随时间增长呈现该变化趋势的原因。

①此反应的正、逆反应速率与浓度的关系为v正=k正c(CO)·c2(H2),v逆=k逆c(CH3OH),其中k正、k逆为速率常数。在温度T下k正、k逆的关系式为k正=k逆。
②若平衡时,在t0时刻再向容器中通入9.0molCO,在图2中画出充入CO后的v正、v逆随时间变化的图像。


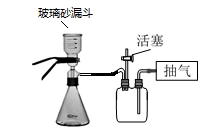
已知:a.AlCl3·6H2O易溶于水、乙醇及乙醚;
b.铵明矾晶体无色、透明,可溶于水、不溶于乙醇。120℃时失去结晶水,280℃以上分解。
请回答:
试题篮