修改时间:2021-05-20 浏览次数:686 类型:月考试卷
| 实验 | 温度℃ | 起始H2O(g)的量/mol | 平衡CO2(g)的量/mol | 达平衡所需时间/min |
| ① | 500 | 5.00 | 2.00 | 40 |
| ② | 800 | 3.00 | 1.00 | 15 |
| ③ | 500 | 3.00 | 1.20 | 9 |
已知几种化学键的键能数据如下表所示:
|
化学键 |
Cl-Cl |
Cl-N |
N=O |
N=O(NO) |
|
键能(kJ·mol-1) |
243 |
a |
607 |
630 |
当Cl2与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为 kJ。(用数字和字母表示)
v(NO)= mol·L-1·min-1
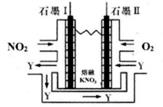
电池工作时,NO2转变成绿色硝化剂Y(N2O5),可循环使用,则石墨Ⅱ为电源极,石墨Ⅱ附近发生的电极反应式为。
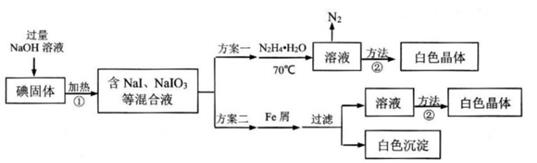
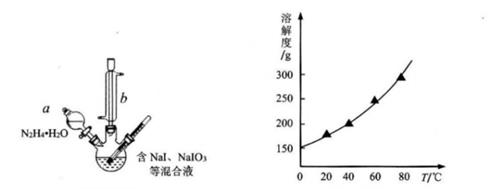
2O3-(aq)+3N2H4·H2O(I)=2I-(aq)+3N2(g)+7H2O(I);△H<0。部分装置如图所示。
①图中仪器b的名称为 。若要使分液漏斗中的液体流入三颈烧瓶中,具体的操作是。
②实验过程中需控制反应温度70℃左右的原因是 。
图中加热的方式最好选用 。
加热蒸发、 、过滤、洗涤得到白色晶体。
试题篮