修改时间:2021-05-20 浏览次数:613 类型:高考真卷

已知:
i. 
ii. 有机物结构可用键线式表示,如 的键线式为
![]()
① 包含2个六元环
② M可水解,与 溶液共热时,1 mol M最多消耗 2 mol

托瑞米芬具有反式结构,其结构简式是。
Ⅰ.用已准确称量的 固体配制一定体积的
标准溶液;
Ⅱ.取 L上述溶液,加入过量
,加
酸化,溶液颜色呈棕黄色;
Ⅲ.向Ⅱ所得溶液中加入 L废水
Ⅳ.向Ⅲ中加入过量KI;
Ⅴ.用 ![]() 标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗
标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗 溶液
L。
已知:
和
溶液颜色均为无色
①反应器中初始反应的生成物为 和
,其物质的量之比为4:1,甲烷和水蒸气反应的方程式是。
②已知反应器中还存在如下反应:
i.
ii.
iii.
·
Ⅲ为积碳反应,利用 和
计算
时,还需要利用 反应的
③反应物投料比采用 ,大于初始反应的化学计量数之比,目的是(选填字母序号)
a.促进 转化
b.促进 转化为
c.减少积碳生成
④用 可以去除
。
体积分数和
消耗率随时间变化关系如下图所示。

从 时开始,
体积分数显著降低,单位时间
消耗率(填“升高”“降低”或“不变”)。此时
消耗率约为
,但已失效,结合化学方程式解释原因:。

①制 时,连接。
产生 的电极方程式是。
②改变开关连接方式,可得 。
③结合①和②中电极3的电极反应式,说明电极3的作用:。
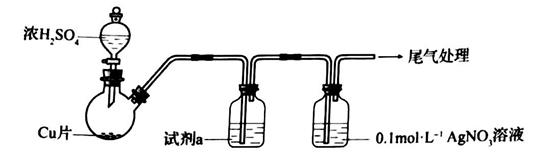
①浓 与Cu反应的化学方程式是
②试剂a是。
(资料: 微溶于水;
难溶于水)
实验二:验证B的成分

①写出 溶于氨水的离子方程式:。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是 ,进而推断B中含有
。向滤液E中加入一种试剂,可进一步证实B中含有
。所用试剂及现象是。
途径1:实验一中, 在
溶液中被氧化生成
,随沉淀B进入D。
途径2:实验二中, 被氧化为
进入D。
实验三:探究 的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有;取上层清液继续滴加 溶液,未出现白色沉淀,可判断B中不含
。做出判断的理由:。
②实验三的结论:。
根据上述实验所得结论:。
试题篮