修改时间:2019-03-06 浏览次数:261 类型:月考试卷
一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g)⇌CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是(填序号).
A.每消耗1mol CO的同时生成2molH2B.混合气体总物质的量不变
C.CH3OH、CO、H2的浓度都不再发生变化D.生成CH3OH的速率与消耗CO的速率相等
②CO的平衡转化率(α)与温度、压强的关系如图所示.A、B两点的平衡常数K(A) K(B)(填“>”、“=”或“<”).
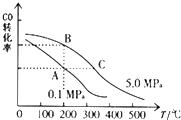
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得c(CO)=0.25mol/L,CO的转化率=,此温度下的平衡常数K=(保留两位有效数字).
钠碱循环法脱硫技术.
n(SO32﹣):n(HSO3﹣) | 91:9 | 1:1 | 1:91 |
PH | 8.2 | 7.2 | 6.2 |
①由如表判断,NaHSO3溶液显性,用化学平衡原理解释:.
②当溶液呈中性时,离子浓度关系正确的是(选填字母):.
a.c(Na+)═c(SO32﹣)+c(HSO32﹣)+c(H2SO3)
b.c(Na+)>c(HSOe﹣)>c(SOe2﹣)>c(H+)═c(OH﹣)
c.c(Na+)═2c(SOe2﹣)+c(HSOe﹣)

时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
阴极产生气体的体积(cm3) | 6 | 12 | 20 | 29 | 39] | 49 | 59 | 69 | 79 | 89 |
阳极产生气体的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
仔细分析以上实验数据,请说出变化的可能原因是.
试题篮