废旧金属可以回收利用,用合金废料(含Fe、Cu和Al)制取FeSO4和CuSO4溶液的实验流程如图(部分生成物已略):
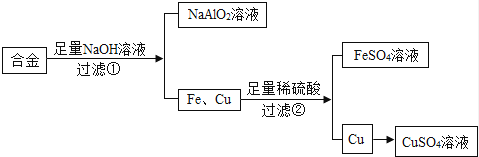
(1)合金属于{#blank#}1{#/blank#} (填“纯净物”或“混合物”);
(2)步骤①反应的化学方程式为:2Al+2NaOH+2R═2NaAlO2+3H2↑,依据质量守恒定律推出R的化学式为{#blank#}2{#/blank#} ,步骤②反应的化学方程式为 {#blank#}3{#/blank#} ;
(3)由Cu制取CuSO4溶液有以下三种途径:
I.Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
Ⅱ.2Cu+O2 2CuO CuO+H2SO4═CuSO4+H2O
2CuO CuO+H2SO4═CuSO4+H2O
Ⅲ.3Cu+8HNO3═3Cu(NO3)+2NO↑+4H2O
你认为最佳途径是{#blank#}4{#/blank#} (填序号),理由是{#blank#}5{#/blank#} .
