题型:综合题 题类:常考题 难易度:困难
四川省成都市2021年高考理综-化学一模试卷
② 4NH3(g) +5O2(g)=4NO(g)+6H2O(l),正、逆反应活化能分别为ckJ/mol、dkJ/mol;则4NH3(g) +6NO(g)=5N2(g)+6H2O(l)的 ΔH 为.
N2(g) +3H2(g) 2NH3(g) ΔH<0
用传感器测得温度为T1、T2时容器中 (N2)随时间变化如下表:
|
|
0 |
5min |
10min |
15min |
20min |
|
T1 |
0.1mol |
0.08mol |
0.062mol |
0.05mol |
0.05mol |
|
T2 |
0.1mol |
0.07mol |
----- |
xmol |
0.06mol |
①T2时,0~5min内 NH3平均速率为v(NH3)=;
②T1时,该反应平衡常数为 (列出计算式);
③ x 0.06(填“>”、“<”或“=”),原因是.
污染物. 反应机理如下[Pt(s)表示催化剂,右上角带“·”表示吸附状态]:
Ⅰ NO + Pt(s)=NO*
Ⅱ CO + Pt(s)=CO*
Ⅲ NO*=N* + O*
Ⅳ CO* + O*=CO2+ Pt(s)
Ⅴ N* + N*=N2+ Pt(s)
Ⅵ NO* + N= N2O+ Pt(s)
经测定汽车尾气中反应物及生成物浓度随温度变化关系如图一和图二所示:
图一 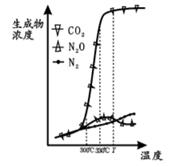 图二
图二 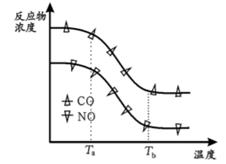
①图一,温度为33℃时发生的主要反应为 (填 “Ⅳ ”、 “Ⅴ ” 或 “Ⅵ ”); 反 应 Ⅵ 为反应(填“放热”或“吸热”).
②图二, 温度从Ta升至Tb的过程中,反应物浓度急剧减小的主要原因是
③气体在固体催化剂表面反应中,吸附和解吸同时影响总反应速率. 温度一定时,反应2NO +2CO N2+2CO2的反应速率随强的变化如图所示. 结合(3)中反应机理,试从吸附和解吸角度解释 bc段化学反应速率下降的原因 .

试题篮