题型:综合题 题类:真题 难易度:普通
2017年浙江省学考选考化学试卷(4月份)
请回答:
2C(s)+O2(g)═2CO(g)△H2=﹣221KJ•mol﹣1
2Al(g)+N2(g)═2AlN(s)△H3=﹣318KJ•mol﹣1
碳热还原Al2O3合成AlN的总热化学方程式是,该反应自发进行的条件.
反应ⅠCO2(g)+4H2(g)⇌CH4(g)+2H2O(g)△H4
反应ⅡCO2(g)+H2(g)⇌CO(g)+H2O(g)△H5
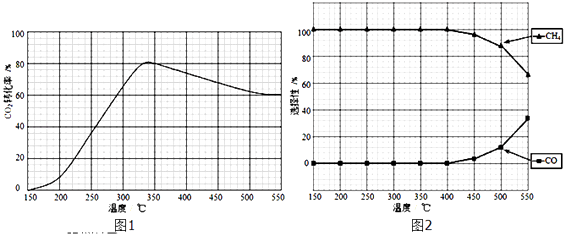
①下列说法不正确的是
A.△H4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为VL该温度下反应Ⅰ的平衡常数为(用a、V表示)
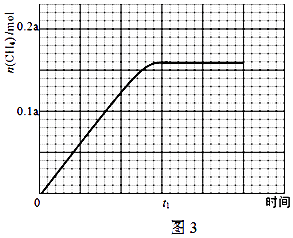
③350℃下CH4物质的量随时间的变化曲线如图3所示.画出400℃下0~t1时刻CH4物质的量随时间的变化曲线.
试题篮