题型:单选题 题类:真题 难易度:普通
云南省2020年中考化学试卷
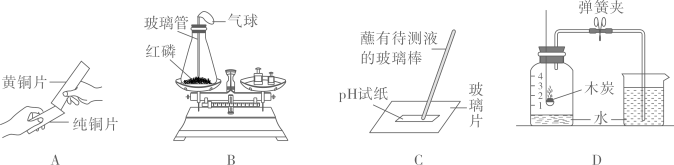
(1)若用酸碱指示剂检验该雨水的酸碱性,方法是{#blank#}1{#/blank#} .
(2)若用pH计每隔几分钟测一次该雨水的pH,数据如表:
|
测定时刻 |
5:05 |
5:10 |
5:15 |
5:20 |
5:25 |
5:30 |
|
pH |
4.95 |
4.94 |
4.92 |
4.88 |
4.86 |
4.85 |
①该雨水是否为酸雨?{#blank#}2{#/blank#}(填“是”或“不是”).
②上表数据的pH能否用pH试纸测得?{#blank#}3{#/blank#}(填“能”或“不能”).
③从上表数据中,你还能得出该雨水的一个结论是{#blank#}4{#/blank#} .
(3)可用于检验该雨水是否为硬水的物质是{#blank#}5{#/blank#} .
试题篮