题型:综合题 题类:模拟题 难易度:困难
安徽省蚌埠市2020年高考理综-化学四模试卷
Sabatier 反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
水电解反应:2H2O(l) 2H2(g)+O2(g)
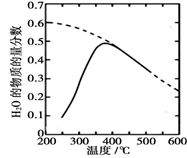
①该反应的平衡常数 K 随温度升高而(填“增大”或“减小”)。
②温度过高或过低均不利于该反应的进行,原因是。
③下列措施能提高 CO2 转化效率的是(填标号)。
A.适当减压
B.增大催化剂的比表面积
C.反应器前段加热,后段冷却
D.提高原料气中 CO2 所占比例
E. 合理控制反应器中气体的流速
为了探究该反应的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2 与CH4 ,使其物质的量浓度均为1.0mol·L-1 , 平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线如图, v正~ c(CH4)和 v逆 ~ c(CO)。则与 v正~ c (CH4)相对应曲线是图中(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度反应重新达到平衡,则此时曲线甲对应的平衡点可能为(填“D”“E”或“F”)。
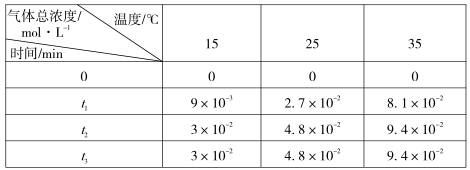
氨基甲酸铵分解反应是(填“放热”或“吸热”)反应。15℃时此反应的化学平衡常数 K =。
① 已知 CO2(g)、H2O(g)的生成焓分别为–394 kJ∙mol-1 、–242 kJ∙mol-1 , Bosch 反应的Δ H =kJ∙mol-1(生成焓指一定条件下由对应单质生成 1mol 化合物时的反应热)。
②一定条件下 Bosch 反应必须在高温下才能启动,原因是。
③该新方案的优点是。
用NH3催化还原NxOy可以消除氮氧化物的污染.
已知:反应I:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)△H1
反应II:2NO(g)+O2(g)⇌2NO2(g)△H2 (且|△H1|=2|△H2|)
反应III:4NH3(g)+6NO2(g)⇌5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)推测反应III是{#blank#}1{#/blank#} 反应(填“吸热”或“放热”)
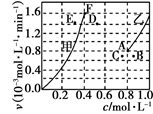
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)={#blank#}2{#/blank#} .
②下列说法正确的是{#blank#}3{#/blank#} .
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H﹣O键与N﹣H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数﹣﹣φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2){#blank#}4{#/blank#} ;恒温恒容容器,φ(NO2){#blank#}5{#/blank#} .
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如图2所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则:
①变为曲线Y改变的条件是{#blank#}6{#/blank#} .变为曲线Z改变的条件是{#blank#}7{#/blank#} .

②若t2降低温度,t3达到平衡,请在上图中画出曲线X在t2﹣t4内 c(N2)的变化曲线.{#blank#}8{#/blank#}
试题篮