题型:实验探究题 题类:真题 难易度:普通
2016年江苏省苏州市中考化学试卷
为测定某市售碳酸钙药品中碳酸钙的质量分数(杂质为SiO2 , 与稀盐酸不反应),某同学的方法是:将样品与稀盐酸反应,测定反应后生成的CO2质量,再根据CO2的质量求出样品中碳酸钙的质量,从而计算出样品中碳酸钙的质量分数.为测定生成CO2的质量,他设计了如下实验方案(已知:无水氯化钙是常见的干燥剂):
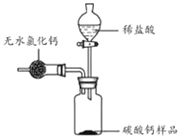
①按图组装好装置,检查装置气密性后,在分液漏斗中加入过量稀盐酸,并在干燥管中加入适量无水氯化钙样品,称得装置和药品的总质量为564.57g;
②在广口瓶中加入碳酸钙样品,称得装置和药品的总质量为574.57g;
③旋紧橡皮塞,打开分液漏斗旋塞,向广口瓶中滴加稀盐酸,使样品与稀盐酸完全反应;
④反应结束后,称得装置及装置内所有物质的总质量为570.57g
请根据上述实验回答下列问题:
下表是20℃时部分物质的溶解度数据。
|
物质 |
Ca(OH)2 |
NaOH |
CaCO3 |
Ca(HCO3)2 |
Na2CO3 |
NaHCO3 |
|
溶解度/g |
0.16 |
109 |
0.0065 |
16.6 |
21.8 |
9.6 |
加入稀硫酸的质量/g | 40 | 65 | 75 |
产生气体的质量/g | 1.1 | 2.2 | 2.2 |
试题篮