题型:实验探究题 题类:常考题 难易度:普通
贵州黔南2018-2019学年九年级上学期理综-化学期末考试试卷
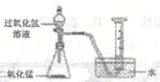
如上图所示进行实验,过氧化氢分解的化学方程式为,产生3.2g02时分解的过氧化氢的质量为g。
同学们进行了如下的实验,实验数据如下表:
|
实验序号 |
① |
② |
③ |
|
H2O2溶液的浓度% |
30 |
30 |
30 |
|
H2O2溶液的体积/mL |
6 |
6 |
6 |
|
温度/℃ |
20 |
35 |
55 |
|
MnO2的用量/g |
0 |
0 |
0 |
|
收集O2的体积/mL |
0 |
1.9 |
7.8 |
|
反应时间 |
40min |
40min |
40min |
由此得出的结论是。
【查阅资料】H2O2溶液有腐蚀性。
【进行实验】
将铜片分别浸泡在3种溶液中进行实验,如下表。
|
编号 |
② |
② |
③ |
|
实验 |
| | |
| 一段时间后的现象 | 无明显变化 | 溶液变蓝,缓慢产生细小气泡 | 无明显变化 |
【解释与结论】
实验①的作用是。
Cu+H2O2+H2SO4=CuSO4+2。
某同学提出,实验②中,除发生(5)的反应外,还发生了一个反应导致有细小气泡产生,该反应的反应物为。
试题篮