修改时间:2024-07-13 浏览次数:210 类型:中考真卷
①氢气作为新能源的优点是(答一条)。
②光伏发电可为电解水制氢气提供电能,光伏发电用到的高纯硅可用SiO2和碳在高温条件下区应制取,同时生成一种可燃性气体。该反应的化学方程式是。
③某种镁铝合金是一种储氢材料。制取该合金通常在真空中熔炼而非空气中熔炼的原因是。
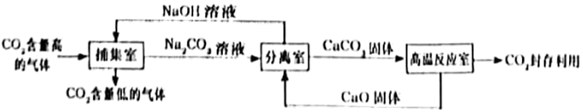
①“捕集室”中发生反应的化学方程式是。“捕集室”中采用喷淋方式加入NaOH溶液,其优点是。
②整个设计流程中,可以循环利用的物质是。(写化学式)
①在高温高压下,CO2和NH3可以合成尿素(CO(NH2)2)同时生成水,该反应中参加反应的CO2与NH3的分子个数比是。
②超临界CO2是指温度与压强达到一定值时,CO2形成气态与液态交融在一起的流体。研究发现超临界CO2流体和水相似,溶解能力强,被誉为“绿色环保溶剂”,下列关于超临界CO2流体的说法正确的是(填序号)。
A.它是混合物 B.它的化学性质与普通二氧化碳相同
C.它的分子不再运动 D.它可代替许多有害、有毒、易燃的溶剂

查阅资料: ;
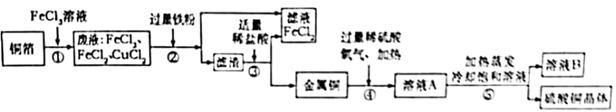
①二氧化锰与浓盐酸加热制取Cl2 ②大理石与稀盐酸制取CO2
③加热氯酸钾与二氧化锰制取O2 ④锌粒与稀硫酸制取H2
a.用稀硫酸吸收 b.用氢氧化钠溶液吸收 c.点燃
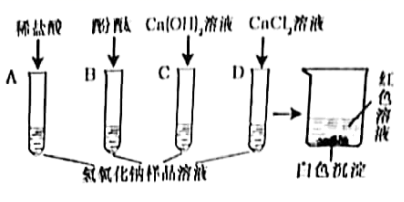
(查阅资料)氯化钙、氯化钡溶液都呈中性。
(实验探究)取适量该氢氧化钠样品,加足量的水溶解,将得到的溶液分别加入到四支试管中,再向四支试管中分别加入稀盐酸(足量)、酚酞试液、氢氧化钙溶液、氯化钙溶液,如图所示:
(提出问题)上层清液呈红色,说明溶液呈碱性。上层清液中呈碱性的物质是什么?
(猜想与假设)上层清液中呈碱性的物质可能是碳酸钠、氢氧化钙和三种物质中的一种或两种。
(现象与结论)
|
预测现象 |
结论 |
|
①若有白色沉淀生成溶液呈红色 |
上层清液中呈碱性的物质是 |
|
②若无沉淀生成溶液呈红色 |
上层清液中呈碱性的物质是氢氧化钙 |
(设计实验)兴趣小组设计并进行了如下图一所示的实验。(装置气密性良好)

将7.1g双青蒿素放在装置C的玻璃管中,燃烧至无固体灰分残留。
①足量NaOH溶液、足量浓硫酸 ②足量浓硫酸、足量NaOH溶液
|
装置 |
反应前的质量/g |
反应后的质量/g |
|
D |
74.7 |
80.1 |
|
E和F |
80.3 |
96.8 |
(实验结论)根据表中数据分析,双青蒿素中碳、氢、氧三种元素的质量比是。
|
实验编号 |
第一次 |
第二次 |
第三次 |
第四次 |
|
加入氢氧化钠溶液质量/g |
10 |
10 |
10 |
10 |
|
烧杯中生成沉淀的总质量/g |
0.464 |
1.044 |
1.160 |
1.160 |
请计算:
试题篮