题型:实验探究题 题类:模拟题 难易度:普通
辽宁省沈阳市东北育才学校2017-2018学年高考理综-化学八模考试试卷
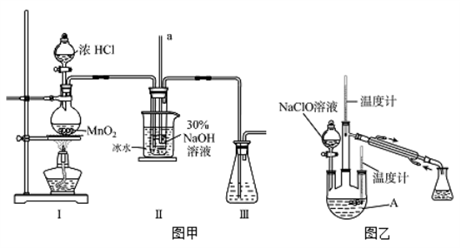
【制备NaClO溶液】实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO 2NaCl+NaClO3
反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
①滴定时,可以选用的指示剂为;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为。
| 实验操作及现象 | 实验结论 | |
| A | 向2mL5%的双氧水中分别滴加2滴0.1mol/L的Fe2(SO4)3和0.1mol/L的CuSO4溶液,前者产生气泡较快 | 对双氧水分解催化效率:Fe3+>Cu2+ |
| B | 向2mL0.1mol/L酸性KMnO4溶液中分别滴加3mL0.1mol/L和3mL0.2mol/L的H2C2O4溶液,后者首先褪色(提示:反应的部分关系为2MnO4-+5H2C2O4—2Mn2++10CO2) | 其他条件不变时,H2C2O4的浓度越大,化学反应速率越快 |
| C | 取两支试管a和b,各加入5mL0.1mol/LNa2S2O3溶液;另取两支试管c和d,各加入5mL0.1mol/LH2SO4溶液;将a、d放入热水浴中, B、c放入冷水浴中,一段时间后分别混合,热水浴中先出现浑浊。(S2O32-+2H+=SO2↑+S↓+H2O) | 温度越高,反应速率越快 |
| D | 用3mL稀H2SO4溶液与足量Zn反应,当气泡稀少时,加入1mL浓H2SO4 , 又迅速产生较多气泡 | H2SO4浓度增大,反应速率加快 |
试题篮