题型:综合题 题类:模拟题 难易度:普通
四川省成都市2017-2018学年高三理综-化学二模考试试卷
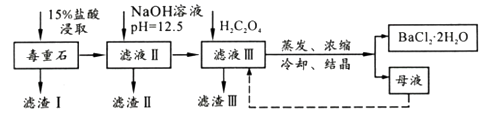
已知:①Ksp(BaC2O4)=1.6×10-7 , Ksp(CaC2O4)=2.3×10-9
②离子浓度小于至1×10-5认为沉淀完全。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
温度(℃) | 常温 | 190〜200 | 470〜480 |
质量(g) | 146.0 | 128.0 | 100.0 |
滤渣III 的成分是(填化学式);200~470℃时发生反应的化学方程式为。
AgCl | AgI | Ag2S | |
Ksp | 1.8×10﹣10 | 8.51×10﹣16 | 6.3×10﹣50 |

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度以0.1mol·L-1计)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Ca(OH)2 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 12.3 | 4.0 | 8.0 |
| 完全沉淀pH | 3.7 | 9.6 | 14.3 | 5.2 | 12.4 |
回答下列问题:
试题篮