题型:综合题 题类:常考题 难易度:普通
化学平衡的计算g 40
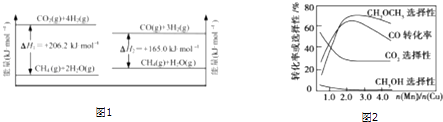
①在压强为0.1MPa条件下,物质的量之比为1:3的CO、H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H<0.若容器体积不变,改变下列条件新平衡下甲醇体积分数增大的是(填字母).
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入N2使体系总压强增大 D.再充入1mol CO和3mol H2
②二甲醚被誉为“21世纪的清洁燃料”.一定条件下利用H2、CO合成CH3OCH3 . 其反应方程式为:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g),该反应的平衡常数表达式为.最近研究发现一种新型的催化剂(主要成分是Cu、Mn的合金)对CO和H2合成二甲醚具有较好的催化效率.根据如图2判断,催化剂中n(Mn)/n(Cu)约为时最有利于二甲醚的合成.
③以甲醇为原料是合成二甲醚的又一途径:2CH3OH(g)⇌CH3OCH3(g)+H2O(g).一定温度下,向2L某容器中充入一定量的CH3OH,10s到达平衡后测得CH3OH 0.04mol,CH3OCH30.08mol,则用甲醇表示反应在10s内的平均反应速率为,相同条件下起始时向该容器中充入CH3OH 0.15mol、CH3OCH30.15mol、和H2O 0.10mol,则反应将向方向进行(填“正反应”或“逆反应”).
选项 | 实验事实 | 解释或结论 |
A | 将一定量HI通入恒温密闭容器中,发生如下反应 | 气体颜色变深说明平衡正向移动, |
B | 向 | 电离平衡向逆方向移动,溶液中的 |
C | 用广泛pH试纸测定 |
|
D | 用铝粉代替铝片与稀盐酸反应,反应速率加快 | 改用铝粉,固体表面积增大,故反应速率加快 |
试题篮