题型:实验探究题 题类:常考题 难易度:普通
浙江省之江教育评价2020-2021学年高三下学期化学开学考试试卷
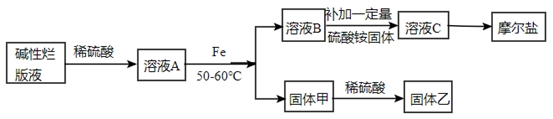 已知:温度超过60℃时, FeSO4在溶液中易形成FeSO4·H2O白色晶体,且一旦产生则难以消失。摩尔盐能溶于水,难溶于乙醇。
已知:温度超过60℃时, FeSO4在溶液中易形成FeSO4·H2O白色晶体,且一旦产生则难以消失。摩尔盐能溶于水,难溶于乙醇。
请回答下列问题:
 B、溶液A与铁粉反应,若温度高于60℃,会导致回收的铜不纯净
C、硫酸铵的用量,可以由溶解的铁粉的量决定,即溶解1mol铁粉,则所加硫酸铵也约为1 mol
D、溶液B的pH控制在5~6之间,若pH过高, 可用硫酸调节,以抑制Fe2+水解
B、溶液A与铁粉反应,若温度高于60℃,会导致回收的铜不纯净
C、硫酸铵的用量,可以由溶解的铁粉的量决定,即溶解1mol铁粉,则所加硫酸铵也约为1 mol
D、溶液B的pH控制在5~6之间,若pH过高, 可用硫酸调节,以抑制Fe2+水解
①用少量冰水洗涤 ②蒸发至较多晶体出现 ③溶液中加入无水乙醇 ④抽滤 ⑤冷却结晶 ⑥干燥

试题篮