题型:综合题 题类:常考题 难易度:普通
2016-2017学年江西省赣州市十四县(市)联考高二下学期期中化学试卷
a.容器中混合气体的密度保持不变 b.SO2体积分数保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
a.向容器中再充人N2 b.向容器中再充入O2
c.改变反应的催化剂 d.降低温度
反应过程 | 化学方程式 | 不同温度下的K | ||
273.15K | 1000K | |||
Ⅰ | 二甲醚羰基化反应 | CH3OCH3(g)+CO(g)⇌CH3COOCH3(g) | 1016.25 | 101.58 |
Ⅱ | 乙酸甲酯加氢反应 | CH3COOCH3(g)+2H2(g)⇌CH3OH(g)+C2H5OH(g) | 103.97 | 10﹣0.35 |
回答下列问题:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
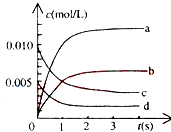
①图中表示NO2变化的曲线是{#blank#}1{#/blank#},用O2表示从0~2s内该反应的平均速率v={#blank#}2{#/blank#}.
②能说明该反应已经达到平衡状态的是{#blank#}3{#/blank#}
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变.
试题篮